MAPEL : IPA
KELAS : 9
MATERI : PARTIKEL PENYUSUN BENDA DAN MAKHLUK HIDUP
PERTEMUAN : KE 1 DARI 3
GURU PENGAMPU : SEPTYANA FORI
WAKTU PEMBELAJARAN : RABU, 21 FEBRUARI 2024
KD : 3.8 Menghubungkan konsep partikel materi (atom, ion, molekul), struktur zat sederhana dengan
sifat bahan yang digunakan dalam kehidupan sehari-hari serta dampak penggunaannya
terhadap kesehatan manusia
TUJUAN : Setelah melaksanakan pembelajaran, siswa diharapkan mampu:
1. Memahami konsep atom, ion, dan molekul
2.Menjelaskan peran atom, ion, dan molekul dalam kehidupan
3. Menjelaskan dampak negatif bahan kimiaterhadap kesehatan manusia
APERSEPSI : - Pada dasarnya macam macam bioteknologi dapat digolongkan menjadi 2, yaitu:
bioteknologi konvensional dan bioteknologi modern.
- bioteknologi konvensional adalah biologi yang menggunakan mikroba untuk
mendapatkan suatu produk barang/ jasa sesuai dengan kebutuhan manusia melalaui
suatu proses fermentasi.
- bioteknologi modern adalah bioteknologi yang
betul-betul mengoptimalkan
pemanfaatan biologi sel dan biologi molekuler
MATERI
Walaupun atom merupakan unit terkecil penyusun molekul, materi yang sudah sangat kecil ini ternyata tersusun dari bagian yang lebih kecil lagi yang disebut partikel subatom.
Amati warna lampu-lampu neon. Masing-masing lampu tersebut berisi gas mulia berturut-turut helium , neon , argon , kripton , dan xenon
Warna Lampu yang Berisi Gas Mulia Helium |
IKATAN ION
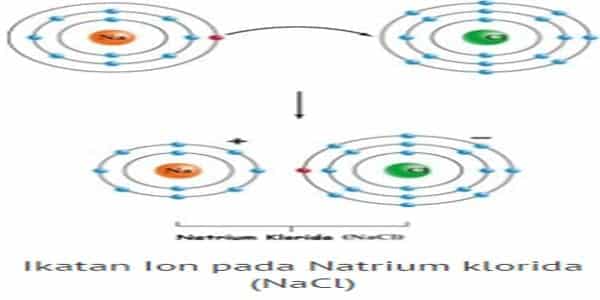
Ikatan ion adalah ikatan yang terjadi akibat perpindahan elektron dari satu atom ke atom lain (James E. Brady, 1990). Ikatan ion terbentuk antara atom yang melepaskan electron (logam) dengan atom yang menangkap elektron (bukan logam). Atom logam, setelah melepaskan elektron berubah menjadi ion positif.
Sedangkan atom bukan logam, setelah menerima elektron berubah menjadi ion negatif. Antara ion-ion yang berlawanan muatan ini terjadi tarik-menarik (gaya elektrostastis) yang disebut ikatan ion (ikatan elektrovalen). Senyawa yang memiliki ikatan ion disebut senyawa ionik. Senyawa ionik biasanya terbentuk antara atom-atom unsur logam dan nonlogam.
Proses terbentuknya ikatan ionik dicontohkan dengan pembentukan NaCl. Natirum (Na) dengan konfigurasi elektron (2,8,1) akan lebih stabil jika melepaskan 1 elektron sehingga konfugurasi elektron berubah menjadi (2,8).
Sedangkan Klorin (Cl), yang mempunyai konfigurasi (2,8,7), akan lebih stabil jika mendapatkan 1 elektron sehingga konfigurasinya menjadi (2,8,8). Jadi agar keduanya menjadi lebih stabil, maka natrium menyumbang satu elektron dan klorin akan kedapatan satu elektron dari natrium.
Ketika natrium kehilangan satu elektron, maka natrium menjadi lebih kecil. Sedangkan klorin akan menjadi lebih besar karena ketambahan satu elektron. Oleh karena itu ukuran ion positif selalu lebih kecil daripada ukuran sebelumnya, namun ion negatif akan cenderung lebih besar daripada ukuran sebelumnya. Ketika pertukaran elektron terjadi, maka Na akan menjadi bermuatan positif (Na+) dan Cl akan menjadi bermuatan negatif (Cl–). Kemudian terjadi gaya elektrostatik antara Na+ dan Cl– sehingga membentuk ikatan ionik.
Ciri-Ciri Atau Sifat Ikatan Ion
Keberdaan ikatan ion mempengaruhi sifat kimia dan fisik dari senyawa yang dihasilkan. Ada ada beberapa karakteristik menonjol dari ikatan ion dan di sini yaitu daftar dari beberapa karakteristik berikut:
- Karena dari kenyataan bahwa logam cenderung kehilangan elektron dan non-logam cenderung untuk mendapatkan elektron, ikatan ion yang umum antara logam dan non-logam. Oleh sebab itu, tidak seperti ikatan kovalen yang hanya bisa terbentuk antara non-logam, ikatan ion bisa terbentuk antara logam dan non-logam.
- Sementara penamaan senyawa ion, nama logam selalu datang pertama dan nama non-logam datang kedua. Misalnya, dalam kasus natrium klorida (NaCl), natrium adalah logam sedangkan klorin adalah non-logam.
- Senyawa yang mengandung ikatan ion mudah larut dalam air serta beberapa pelarut polar lainnya. Ikatan ion, dengan demikian, mempunyai efek pada kelarutan senyawa yang dihasilkan.
- Ketika senyawa ion dilarutkan dalam pelarut untuk membentuk larutan homogen, larutan cenderung untuk menghantarkan listrik.
- Ikatan ion mempunyai efek pada titik leleh senyawa juga, karena senyawa ion cenderung mempunyai titik leleh yang lebih tinggi, yang berarti bahwa ikatan ion tetap stabil untuk rentang suhu yang lebih besar.
EVALUASI:




Tidak ada komentar:
Posting Komentar