ION DAN IKATAN ION
IPA KELAS 9, SENIN 1 MARET 2021
KD : Memahami konsep dasar ion dan ikatann ion dalam kehidupan sehari-hari
TUJUAN : Siswa dapat memahami konsep tentang ion dan ikatan ion serta manfaatnya dalam kehidupan sehari-hari
Assalamualaikum wr wb
Anak-anak ibu yang sholeh dan sholeha apa kabarnya......baik ya, sudah mengerjaka sholat dhuha dan murojoah pagi ini...... Alhamdullilah. Baiklah anak -anak pagi ini materi yang akan ibu sampaikan tentang ion dan ikatan ion serta manfaatnya dalam kehidupan silahkan kalian baca materi di bawah ini tetap semangat dan jaga kesehatan terima kasih
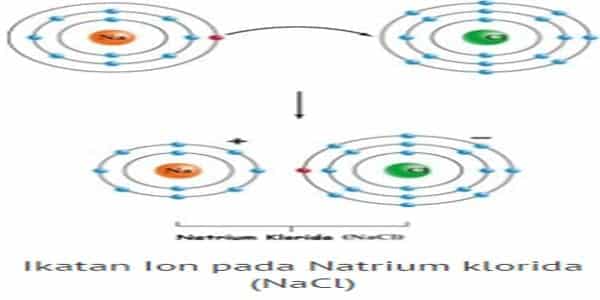
- Ikatan ion adalah ikatan yang terjadi akibat perpindahan elektron dari satu atom ke atom lain (James E. Brady, 1990). Ikatan ion terbentuk antara atom yang melepaskan electron (logam) dengan atom yang menangkap elektron (bukan logam). Atom logam, setelah melepaskan elektron berubah menjadi ion positif.
Sedangkan atom bukan logam, setelah menerima elektron berubah menjadi ion negatif. Antara ion-ion yang berlawanan muatan ini terjadi tarik-menarik (gaya elektrostastis) yang disebut ikatan ion (ikatan elektrovalen). Senyawa yang memiliki ikatan ion disebut senyawa ionik. Senyawa ionik biasanya terbentuk antara atom-atom unsur logam dan nonlogam.
Proses terbentuknya ikatan ionik dicontohkan dengan pembentukan NaCl. Natirum (Na) dengan konfigurasi elektron (2,8,1) akan lebih stabil jika melepaskan 1 elektron sehingga konfugurasi elektron berubah menjadi (2,8).
Sedangkan Klorin (Cl), yang mempunyai konfigurasi (2,8,7), akan lebih stabil jika mendapatkan 1 elektron sehingga konfigurasinya menjadi (2,8,8). Jadi agar keduanya menjadi lebih stabil, maka natrium menyumbang satu elektron dan klorin akan kedapatan satu elektron dari natrium.
Ketika natrium kehilangan satu elektron, maka natrium menjadi lebih kecil. Sedangkan klorin akan menjadi lebih besar karena ketambahan satu elektron. Oleh karena itu ukuran ion positif selalu lebih kecil daripada ukuran sebelumnya, namun ion negatif akan cenderung lebih besar daripada ukuran sebelumnya. Ketika pertukaran elektron terjadi, maka Na akan menjadi bermuatan positif (Na+) dan Cl akan menjadi bermuatan negatif (Cl–). Kemudian terjadi gaya elektrostatik antara Na+ dan Cl– sehingga membentuk ikatan ionik.
Ciri-Ciri Atau Sifat Ikatan Ion
Keberdaan ikatan ion mempengaruhi sifat kimia dan fisik dari senyawa yang dihasilkan. Ada ada beberapa karakteristik menonjol dari ikatan ion dan di sini yaitu daftar dari beberapa karakteristik berikut:
- Karena dari kenyataan bahwa logam cenderung kehilangan elektron dan non-logam cenderung untuk mendapatkan elektron, ikatan ion yang umum antara logam dan non-logam. Oleh sebab itu, tidak seperti ikatan kovalen yang hanya bisa terbentuk antara non-logam, ikatan ion bisa terbentuk antara logam dan non-logam.
- Sementara penamaan senyawa ion, nama logam selalu datang pertama dan nama non-logam datang kedua. Misalnya, dalam kasus natrium klorida (NaCl), natrium adalah logam sedangkan klorin adalah non-logam.
- Senyawa yang mengandung ikatan ion mudah larut dalam air serta beberapa pelarut polar lainnya. Ikatan ion, dengan demikian, mempunyai efek pada kelarutan senyawa yang dihasilkan.
- Ketika senyawa ion dilarutkan dalam pelarut untuk membentuk larutan homogen, larutan cenderung untuk menghantarkan listrik.
- Ikatan ion mempunyai efek pada titik leleh senyawa juga, karena senyawa ion cenderung mempunyai titik leleh yang lebih tinggi, yang berarti bahwa ikatan ion tetap stabil untuk rentang suhu yang lebih besar.
Setelah kalian membaca materi diatas silahkan kalian rangkum di buku latihan diberi nama dan kelas kirimkan ke WA ibu
Terima Kasih
Wassallamualaikum wr wb
Terimakasih Bu
BalasHapus-Nabilla Syahiya 9C
terimakasih bu
BalasHapusfaiz daka w 9c
Terimakasih bu
BalasHapus-Clarisma Hana A 9C
Terimakasih bu
BalasHapusM.fauzan Oktriananda 9C
Terima kasih Bu
BalasHapus-sasta humayra 9c
Terimakasih bu
BalasHapus-Alisa Awaliyah 9C
Terimakasih bu
BalasHapusRafi ahmad b 9c
Terimakasih bu
BalasHapusAurora zahrani f 9c
Terimakasih Bu
BalasHapusM.Dzaky Taruna 9c
Terimakasih bu
BalasHapusSyahwal Aziz Pradana 9c
Terima kasih bu
BalasHapus—Saskia salsabila 9C
Terima kasih bu
BalasHapusMuhammad vasech aljabbar 9c
terima kasih bu
BalasHapusAleya syamadha T 9c
Terimakasih bu
BalasHapus-dhea rachma 9C
Terima kasih Bu
BalasHapusAlwahid Alfareza S 9C